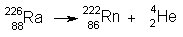
Naravna radioaktivnost
Na
koncu 19. stoletja je francoski znanstvenik Becquerel opazil, da uran seva žarke,
ki počrne fotografsko ploščo in ionizirajo zrak. Marija in Pierre Curie sta
začela z raziskavo teh pojavov in sta ugotovila, da uranova smolna ruda vsebuje
snovi, ki še bolj intenzivno sevajo žarke kot uran. Tako sta odkrila dva nova
elementa: polonij in radij.
Pojav sevanja žarkov je značilen predvsem za elemente z visokimi vrstnimi števili. Elemente, ki sevajo žarke, imenujemo radioaktivne elemente, sam pojav, ki poteka spontano pa naravna radioaktivnost. Po obnašanju v magnetnem polju so ugotovili, da naravne radioaktivne snovi sevajo tri vrste žarkov: žarke a, ki se v magnetnem polju odklonijo k negativnemu polu, žarke b, ki se odklonijo k pozitivnemu polu in žarke g, ki prehajajo neovirano skozi magnetno polje.
Žarki a so helijeva jedra. Vsak delec a ima dva pozitivna naboja in maso 4. Gibljejo pa se s hitrostjo, ki ustreza 1/10 do 1/20 svetlobne hitrosti. Žarki b so elektroni. Imajo negativni naboj in se gibljejo s hitrostjo, ki je približno enaka svetlobni hitrosti. Žarki g so fotoni z zelo kratko valovno dolžino.
Ko atomsko jedro odda delec a,
se zmanjša pozitivni naboj prvotnega atomskega jedra za dve enoti, njegovo
masno število pa za štiri enote. Pri tem nastane jedro elementa, ki je v
periodi čnem sistemu dve mesti pred prvotnim elementom. Primer:
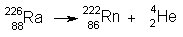
V jedru radija je 88 protonov in 138 nevtronov. Ko radij odda delec a, preide v radon, ki ima vrstno število 86 (88-2) in masno število 222 ( 226-4 ).
Z oddajo delca b iz jedra atoma nastane novo jedro, ki ima vrstno število za eno višje od jedra, ki ga je oddalo. Pri tem razpade nevtron v proton in elektron (n ® p + e-). Primer:
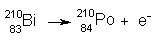
Bizmut
odda delec b in preide v polonij. V jedru bizmuta je 83 protonov in 127 nevtronov.
Nevtron preide v proton in jedro odda elektron. Nastali element polonij
ima v jedru 84 protonov in 126 nevtronov, Masno število se ne spremeni (84 +
126 = 210).
S
sevanjem žarkov g
se število protonov in nevtronov v jedru ne spremeni. Zmanjša se le notranja
energija jedra.
Razpadne
družine:radioaktivni elementi oddajajo žarke in prehajajo v druge
elemente, ki naprej razpadajo do elementa, ki ni več radioaktiven. Poznamo štiri
družine radioaktivnih elementov: aktinijevo, uranovo, torijevo in neptunijevo.
Razpolovni
čas:za radioaktivni razpad elementov je pomemben pojem razpolovnega
časa. Razpolovni čas je čas, v katerem razpade polovica atomov radioaktivnega
elementa. Razpolovni čas je lahko le del sekunde, lahko pa je tudi več
milijonov let. Za izotop radija 226 je razpolovni čas 1622 let. To pomeni, da
od 1 grama radija ostane po 1622 letih le 0,5 grama.
Mera za aktivnost radioaktivnih snovi je curie, oznaka Ci. Aktivnost 1 Ci ima snov s 3,7 · 1010 razpadi na sekundo (prvotno je bil definiran kot število razpadov v sekundi 1 grama radija).
Snovi, ki zelo počasi razpadajo, kot na primer uran, lahko uporabimo za določevanje starosti zemeljskih plasti. 1 gram urana 238U, ki ima razpolovni čas 4,5 · I09 let, se razgradi v tem času na 0,5 gramov urana in pri tem nastane 0,067 gramov helija in 0,4326 gramov svinca 206Pb. Iz vsakega atoma 238U, ki se razgradi, n stane 8 atomov helija s skupno maso 32 in en atom svinca z maso 206. Z analizo ugotavijo razmerje med uranom in svincem v kamenini in iz tega razmerja sklepajo na starost kamenine.
Po
zelo zanimivem postopku določijo starost tistih snovi, ki vsebujejo ogljik.
Merijo namreč aktivnost, ki jo povzroča ogljik 14C
(ogljikova ura). Po tem načinu lahko določijo tudi starost do 50.000
let z natančnostjo 200 let
14C nastaja v zunanjih slojih atmosfere iz dušika in nevtronov (iz kozmičnih žarkov):
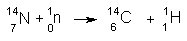
Nastali
izotop ogljika je radioaktiven in ima razpolovni čas 5760 let. V atmosferi je
vedno določeno razmerje med obstojnim izotopom ogljika 12C
in radioaktivnim 14C.
Razmerje je 1012
: 1. Ogljik prehaja v ogljikov dioksid in ga sprejmejo organizmi. Tudi v
organizmih je razmerje 12C
: 14C
= 1012
:
1. Ko organizem odmre se količina 14C
manjša. Po 5760 letih je še polovica in po 11520 letih še ena četrtina
prvotne količine 14C.
To pomeni, da lahko iz aktivnosti (sevanja) izračunamo starost odmrlih
organizmov. Na ta način so določili starost ledcne dobe, čas erupcijc
nekaterih vulkanov, starost ognjišč v predzgodovinskih jamah in podobno.