Kisik in kisikove spojine
Kisik:
Je najpogostejši element v zemeljski skorji, v zraku ga je 21 vol.%. Obstaja v dveh modifikacijah, običajni kisik (dikisik)O2 in ozon(trikisik)O3.
Kisik O2
Tehnično ga pridobivajo iz zraka s frakcionirano kondenzacijo in destilacijo in s segrevanjem soli, ki vsebujejo mnogo kisika(klorati, nitrati manganati, peroksidi), skatalitskim razkrojem vodikovega peroksida, z elektrolizo raztopin hid roksidov ali sulfatov, iz peroksidov alkalij skih kovin. Kisik je brezbarven plin, brez vonja in okusa, potreben vsem živim bitjem za di hanje. Tekoč in trden kisik sta svetlo modre barve. Pri običajni temeperaturi je precej nere aktiven, pri višjih pa je zelo reaktiven. Reakcijo spajanja s kisikom imenujemo oksidacija-nastanejo oksidi, hitra oksidacija je gorenje.. Kisik polnijo v jeklenke modre barve, 15 MPa, uporabljajo ga za varjenje kovin, za dihalne aparate, za pogon raket, za mnoge kemijske rakcije.
Ozon O3
Nastaja v kisiku ali zraku ob razelektritvi, pri temni razelektritvi in pri osvetljevanju z UV svetlobo, dobijo ga tudi pri elektrolizi žveplove(VI)kisline.Ozon je plin sveztlo modre barve, z značilnim električnim vonjem, pri segrevanju eksplodira, je zelo močno oksidacijsko sredstvo. Upora bljajo ga za dezinfekcijo vode in zraka v bolnišnicah in za razstrupljanje industijskih odpadnih voda. Ozon, ki je v stratosferi, v višini 25 km, ščiti življenje na Zemlji pred nevarnim UV sevanjem.
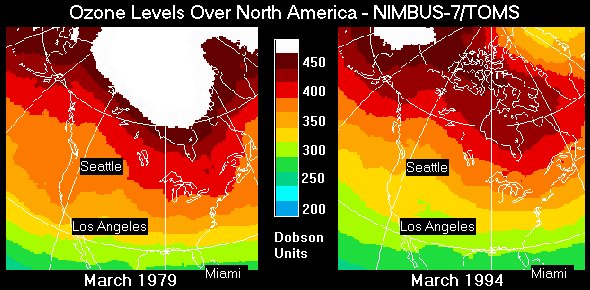
Ozonska luknja, nastala zaradi vpliva kemikalij, pogled na s.Ameriko, 1979 in 1994

Spojine kisika
Oksidi:oksidi nekovin so običajno anhidridi kislin, oksidi kovin pa običajno anhidridi baz.
Spojine, ki vsebujejo -OH skupino: so lahko bazične, kisle ali amfoterne.
Peroksidi: vsebujejo peroksidni most -O-O-, oksidacijsko število kisika je -1. Pomembna peroksida sta natrijev in barijev peroksid, Na2O2 in BaO2. Hiperperoksidi(superoksidi) vsebujejo enovalentni ion O2-, primer je kalijev hiperoksid KO2.
Žveplo in žveplove spojine
Žveplo
Pridobivajo ga v naravi v elementarnem stanju in v spojinah, v industriji iz žveplovega dioksida.



Žveplo v naravi
Ima več alotropskih oblik, tvori verige in obroče. Pri sobni temperaturi je najbolj stabilna oblika rombsko ali alfa žveplo, ki je v obliki majhnih kristalov in jo sestavljajo kroni podobni obroči S8. S povečanjem temperature na 96 0 C nastane bolj stabilna alotropska oblika mono klinsko žveplo, ki je zgrajeno iz igličastih kristalov, sestavlajo pa ga prav tako obroči S8, ki pa so zloženi manj urejeno kot rombsko žveplo. Pri nadaljnem segrevanju postane tekočina bolj viskozna, obroči S8 se cepijo, nastanejo prepletene verige atomov S,če staljeno žveplo zlijemo v vodo, da se hitro ohladi, nastane gumijasta masa-plastično žveplo.
Žveplo je reaktiven element, reagira s halogeni, z vodikom, kisikom, večino nekovin in kovin, ni strupeno, dobro se topi v ogljikovem disulfidu.
 Gorenje:spajanje žvepla in cinka
Gorenje:spajanje žvepla in cinka
Uporaba za proizvdnjo žveplove(VI)kisline, pri vulkanizaciji gume, za razkuževanje sodov, za sintezo različnih žveplovi spojin.
 Notranja zgradba žvepla
Notranja zgradba žvepla  Kristal
žvepla
Kristal
žvepla
Žveplovi oksidi
Žveplov dioksid SO2:
Na zraku ali kisiku zgori žveplo z modrim plamenom v žveplov dioksid
S + O2 ----- SO2
Žveplov dioksid nastane tudi pri segrevanju sulfidov, pri gorenju snovi, ki vsebujejo žveplo(žveplovodik, premog, organske snovi)
Žveplov dioksid je brezbarven, strupen, dušljiv plin, onesnažuje okolje, povzroča poleg drugih snovi kisli dež. V vodi se raztaplja, v vodni raztopini je kislina, tvori dve vrsti soli, hidrogen sulfate(IV) npr. NaHSO3 in sulfate(IV) npr. Na2SO3. Je močan reducent, uporaba med drugim za razvijanje črnobele fotografije.Iz dimnih plinov termoelektrarn ga očistijo po reakciji:
SO2+MgO --- MgSO3 dalje pri 750 0C --- MgO + SO2, dalje v žveplovo(VI)kislino
Žveplov trioksid SO3:
Žveplov dioksid je izhodna surovina za žveplov trioksid, ki nastane pri oksidaciji SO2 v prisotnosti katalizatorjev kot sta platina in vanadijev(V) oksid. SO3 je trdna snov, znane so tri polimorfne oblike. Z vodo reagira v žveplovo(VI) kislino.
Žveplovodik in sulfidi:
Žveplovodik H2S:
Nastane po reakciji S + H2 ---- H2S ali po reakciji FeS + 2 HCl ---- H2S + FeCl2
Žveplovodik ima značilen vonj po gnilih jajcih, je izjemno strupen plin, na srečo pa ga zaznamo že pri razredčitvi 1: 1000000. Je močan reducent 2H2S + O2 ---- 2 SO 2 + 2 H2O. V vodi se topi, vodne raztopine so kisle, tvori dve vrsti soli hidrogensulfide npr. NaHS in sulfide npr. Na2S. Mnogi sulfidi si pomembne rude:

Svinčev sijajnik ali galenit PbS
Žveplova(VI)kislina in sulfati(VI)
Žveplova(VI) kislina H2SO4:
Pridobivajo jo lahko s homogeno katalizo, katalizator je NO. Izhodne surovine so SO2, kisik iz zraka , voda in NO: SO2 + H2O + NO2 --- H2SO4 + NO
Drugi postopek je oksidacija SO2 ob prisotnosti katalizatorjev V2O5 ali platine, nastane SO3, tega uvajajo v koncentrirano H2SO4, dobijo H2S2O7 , z razredčevanjem z vodo nastane brezvodna H2SO4.
Koncentrirana H2SO4(96%) je močan oksidant, uporablja se v kemijskih laboratorijih, v velikih količinah pa v različnih tehnoloških postopkih. Zlasti močan oksidant je, če je segreta:
Cu + 2H2SO4 ---- CuSO4 + SO2 + 2H2O
C + 2H2SO4 ---- CO2 + 2SO2 + 2H2O
2Al + 6H2SO4 ---- Al2(SO4)3 + 3SO2 + 6H2O
Razredčena nima oksidacijskih lastnosti. Koncentrirana H2SO4 je zelo higroskopna, zelo močno veže vodo, ki jo odvzame tudi spojinam, saj sladkor ali les poogljenita. pri mešanju z vodo se močno segrej, zato vedno nalivaj med mešanjem kislino v vodo in nikoli obratno. Razredčena H2SO4 je močna kislina. Daje dve vrsti soli hidrogensulfate(VI) npr. NaHSO4 in sulfate(VI) npr. Na2SO4.
Sulfati(VI):
Na2SO4 . 10 H2O natrijev sulfat(VI) ali Glauberjeva sol
MgSO4 . 7 H2O magnezijev sulfat(VI) ali grenka sol
Galice so sulfati(VI) dvovalentnih kovin s kristalno vodo:
FeSO4 . 7 H2O železov(II)v sulfat(VI) ali zelena galica
ZnSO4 . 7 H2O cinkov(II)v sulfat(VI) ali bela galica
CuSO4 . 5 H2O bakrov sulfat(VI) ali modra galica
Selen in selenove spojine
Selen:

Redek, pogosto je primešan skupaj s telurjem žveplu v sulfidih. Pridobivajo ga iz anodnega blata pri rafinaciji bakra. Obstaja v sivi(kovinski) selen,v temi slabo pre vaja tok, z osvetlitvijo pa njegova prevodnost naraste, Rdeči selen(nekovinski) je neobstojen. Selen uporabljajo za fotocelice in za usmernike električnega toka.
Telur in telurjeve spojine
Telur:

Redkejši kot selen, najdemo ga skupaj je primešan skupa s selenom in žveplom v sulfidih. Telur je v obliki srebrno belih, mehkih, krhkih kristalih.Telur uporabljajo v tehniki polprevodnikov.
Polonij
Polonij:
Je radioaktiven element, zelo redek, pridobivajo ga umetno z obstreljevanjem bizmuta v jedrskih reaktorjih, razpolovna doba najbolj dolgoživega izotopa je 102 lti. Polonij je srebrno bela, bleščeča kovina, ki neprestano oddaja modro svetlobo.
