Dne 10. 4. 1998 je na gimnaziji potekalo šolsko tekmovanje iz kemije. Tekmovanje je potekalo 45 minut, in sicer pod mentorstvom prof. kemije Margarete Šavli. Tekmovali so le dijaki prvih in drugih letnikov. Spodaj si lahko ogledate uvrstitve in naloge, ki so jih dijaki na tekmovanju reševali.
- Rezultati: 1.letnik, 2.letnik
REZULTATI:
1. LETNIK: Izmed 64 učencev se je tekmovanja udeležilo 19 učencev (11 iz 1.aG in 8 iz 1.bG).
Dijaki so se uvrstili po sledečih mestih:
|
MESTO |
DIJAK |
|
1. |
Tomaž KUZMA, 1.aG |
|
2. |
Irena BRUNSKOLE, 1.aG |
|
3. |
Anja KRAMARIČ, 1.aG |
|
4. |
Jan ŠAVLI, 1.aG |
|
5. |
Mirjam GOSENCA, 1.bG |
|
6. |
Sašo JERŠIN |
|
7. |
Maja AMBROŽIČ
Uroš ZORC |
|
8. |
Peter BUTALA |
|
9. |
Peter SKUBE |
|
10. |
Martina ŽUGELJ
Darja PETRIC |
|
11. |
Tadeja LAMUT
Igor ANGELOVSKI |
|
12. |
Matej MEDEK
Dina PLUT |
|
13. |
Vesna ŠPEHAR |
|
14. |
Marija JUDNIČ |
|
15. |
Jana SOKOLIČ |
2. LETNIK: Izmed 63 učencev so se tekmovanja udeležili 4 učenci (2 iz 2.aG in 2 iz 2.bG), ki so se razvrstili po sledečem vrstnem redu:
|
MESTO |
DIJAK |
|
1. |
Tihomir TOMAŠIČ, 2.bG |
|
2. |
Tomaž KAPELE, 2.aG |
|
3. |
Sanela FAZLIĆ, 2.aG |
|
4. |
Marjetka PEZDIRC, 2.bG |
NALOGE: Vse naloge zbrala in priredila
NALOGE ZA 1.LETNIK Margareta Šavli, dipl. ing. kem
1. Pri termičnem razkroju čiste kemijske snovi smo dobili dva različna plina -kemijsko čisti snovi. Na osnovi navedenega lahko z gotovostjo trdimo:
2. Za najlažji možni atom elementa, ki ima v osnovnem stanju v podlupinah (n -1)d
8 elektronov in ns 2 elektrona (n je glavno kvantno število), velja:
Obkroži kombinacijo pravilnih trditev:
A) a, d B) a, c C) b, e D) b, c, e E) a, d, e
3. Skupno število vseh valenčnih elektronov v karbonatnem ionu ( CO32- ) je:
A) 2 B) 8 C) 22 D) 24 E) 32
4. Obkroži kombinacijo formul, katere predstavljajo same linearne molekule.
A) CO2, BeCl2, HCN
B) CO2, O2, H2O
C) CO2, SO2, BeF2
D) H2O, HCN, C2H2
E) SO2, H2, HBr
5. Na osnovi formule Pr3(PO4)4 določi formulo ustreznega oksida elementa Pr.
A) PrO
B) PrO2
C) Pr2O3
D) Pr3O4
E) PrO3
6. Oglej si spodnjo kemijsko reakcijo:
2 MnO2 + 4 KOH + O2 + Cl2 ® 2 KMnO4 + 2 KCl + 2 H2O
Od katerega reagenta je odvisna množina nastalih produktov, če smo na začetku imeli po 100,0 g vsakega od reagentov?
A) MnO2
B) KOH
C) O2
D) Cl2
E) Od vseh enako.
7. Delce: atom Kr, najpogostejši ion Rb in najpogostejši ion Sr razporedi po naraščajočem radiju.
8. Spojina vsebuje 25,2 % žvepla in 74,8 % fluora. Pri temperaturi 20oC in tlaku 10,13 kPa ima 0,254 g te spojine volumen 0,240 litra. Določi formulo spojine.
9. Izračunaj, koliko nevtronov je v 5,5 litra kisika pri normalnih pogojih.
10. 10,0 gramov nekega bakrovega oksida segrevamo v plinastem vodiku. Pri tem nastane določena masa bakra in 1,26 g vode. Izračunaj masni delež bakra v oksidu.
11. Za spodnji reakciji je navedena standardna tvorbena entalpija:
2 Zn + O2 ® 2 ZnO D Ht = - 696 kJ
2 C + O2 ® 2 CO D Ht = - 228 kJ
Izračunaj spremembo standardne entalpije za sledečo kemijsko reakcijo:
ZnO + C ® Zn + CO
1. Vodni raztopini barijevega sulfata (BaSO4 (aq)) smo dodali trden natrijev sulfat (Na2SO4 (s)). Kako bo to vplivalo na nastalo ravnotežje?
A) Koncentracija Ba2+ se ne spremeni.
B) Nekaj trdnega barijevega sulfata se raztopi.
C) Nekaj trdnega barijevega sulfata se obori.
D) Vrednost konstante topnosti za barijev sulfat se poveča.
E) Vrednost konstante topnosti za barijev sulfat se zmanjša.
2. Katera od navedenih vodnih raztopin je najboljši električni prevodnik?
A) 0,10 M raztopina H2SO4
B) 0,10 M raztopina H2CO3
C) 0,10 M raztopina HNO3
D) 0,10 M raztopina NaOH
E) 0,10 M raztopina NH3
3. Na osnovi formule Pr3(PO4)4 določi formulo ustreznega oksida elementa Pr.
A) PrO
B) PrO2
C) Pr2O3
D) Pr3O4
E) PrO3
4. V katerih od sledečih primerov zapis predstavlja kislino / konjugirano bazo?
a) NH3 / NH4+
b) H2O / H3O+
c) HSO4- / SO42-
d) H3O+ / H2O
e) H3O+ / OH-
Obkroži kombinacijo pravilnih trditev:
A) a, b B) b, d, e C) c, d, e D) c, d E) a, b, e
5. Za nevtralizacijo 50,0 mL 0,20 molarne raztopine H2SO4 razredčene na 75,0 mL smo porabili 35,0 mL raztopine NaOH. Kolikšna je bila koncentracija NaOH?
A) 0,1000 mol/L
B) 0,2857 mol/L
C) 0,4285 mol/L
D) 0,5714 mol/L
E) 1,7140 mol/L
6. Uredi spodnjo redoks reakcijo :
Cr2O72- + Fe2+ + H3O+ ® Cr3+ + Fe3+ + H2O
Obkroži nepravilno trditev za zgornjo reakcijo:
A) Oksidacijsko število kroma se spremeni s +6 na +3.
B) Koncentracija oksonijevih ionov se pri reakciji zmanjšuje.
C) Fe2+ ioni so reducenti.
D) Cr2O72- ioni se reducirajo v Cr3+ ione.
E) Pri reakciji poteka redukcija Fe2+ ionov.
7. Na grafu, ki prikazuje spreminjanje električne prevodnosti pri dodajanju barijevega hidroksida klorovodikovi kislini, so označene štiri točke.Napiši, kateri ioni v raztopini v dani točki prevajajo električni tok.
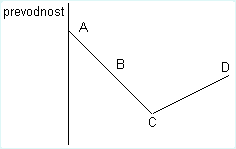
Točka A: _____________________
Točka B: _____________________
Točka C: _____________________
Točka D: _____________________
V (Ba(OH)2)
8. 10,0 mililitrom raztopine amonijevega sulfata dodamo prebitek natrijevega hidroksida. Nastali amoniak uvajamo v 50,0 mL 0,10 molarne raztopine klorovodikove kisline. Za nevtralizacijo klorovodikove kisline, ki ni reagirala, smo porabili 21,50 mL 0,0980 M razt. natrijevega hidroksida. Izračunaj množinsko koncentracijo amonijevega sulfata.
9. Ravnotežna reakcija ima pri določeni temperaturi vrednost konstante 4. Izračunaj
ravnotežno množino ogljikovega monoksida, če je začetna množina ogljikovega monoksida in vode 1,0 mol. Volumen reakcijske zmesi je 1 liter.
CO (g) + H2O (g) Ű CO2 (g) + H2 (g)
10. 200 mililitrom raztopine s pH = 2,4 dodamo 400 mililitrov raztopine s pH = 3. Izračunaj pH dobljene raztopine. Disociacija je popoplna.